Естер вс. Етхер

Садржај
Естер и етер су органски молекули са атомима кисеоника. Обоје имају везу етра која је –О-. Естери имају групу -ЦОО. Један атом кисеоника везан је за угљеник двоструком везом, а други кисеоник везом са једном везом. Пошто су само три атома повезана са атомом угљеника, он има тригоналну равнинску геометрију око себе. Даље, атом угљеника је сп2хибридизирани.
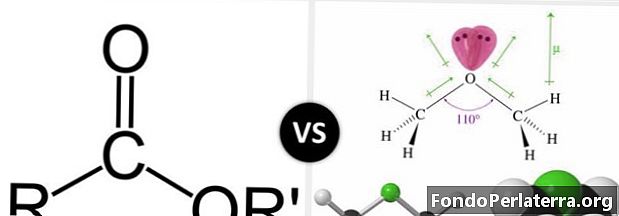
Карбоксилна група је функционална група која се широко јавља у хемији и биохемији. Ова група је родитељ из сродне породице једињења познатих као ацил једињења. Ацил једињења су такође позната као деривати карбоксилне киселине. Естер је такав карбоксилни дериват. Естер једињења поседује везу угљеник-карбонил-кисеоник, док етерско једињење има везу угљеник-кисеоник-угљеник.
Садржај: Разлика између Естера и Етера
- Шта је Естер?
- Шта је Етер?
- Кључне разлике
- Видео објашњење
Шта је Естер?
Естери имају општу формулу РЦООР-а '. Естери се добијају реакцијом између карбоксилне киселине и алкохола. Естери се називају тако што се најпре напишу имена дела алкохолног пића. Тада се име настало од киселог дела пише са завршетком -Појео или -оате.

Шта је Етер?
Етери имају функционалну групу РОР нпр. Етоксипропан. Етер је једињење које има везу угљеник-кисеоник-угљеник. Етери се могу произвести интермолекуларном дехидрацијом алкохола. То се обично дешава на нижим температурама од дехидрације алкена.

Кључне разлике
- Естери су деривати карбоксилне киселине и имају групу -ЦОО. Етери имају -О-функционалну групу.
- Естер има карбонилну групу поред -О-кисеоника, али етер нема такве.
- Естери имају толико карактеристичних мириса.
- Естери се лако хидролизују да би се добио алкохол и карбоксилна киселина за разлику од етера.
- Естери имају функционалну групу РЦООР са двоструком везом Ц на један од Ос и једном везом на други О. нпр. Етил етаноат. Док етри имају функционалну групу РОР, нпр. Етоксипропан
- Етер је једињење које има везу угљеник-кисеоник-угљеник. Пример етра је етоксилат. Једињење испод је лауретх 5. С друге стране, естер је једињење које има угљеник-карбонил-кисеоник угљендну везу.
- Примарна карактеристика која разликује естер од етра је њихова различита структура. Једињење познато као естер поседује везу угљеник-карбонил-кисеоник, док етерско једињење има везу угљеник-кисеоник-угљеник.
- Естери су поларна једињења, али они немају способност да формирају снажне водоничне везе једни са другима због недостатка везане за водоник за кисеоник. Као резултат тога, естери имају ниже тачке кључања у поређењу са киселинама или алкохолима са сличним молекуларним тежинама. Етери се могу произвести интермолекуларном дехидрацијом алкохола. То се обично дешава на нижим температурама од дехидрације алкена. Виллиамсонова синтеза је још једна метода за производњу несиметричних етера.